Februar 2012, Nr. 35
CAMPUS
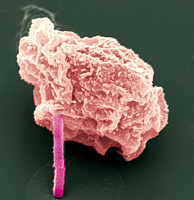
Elektronenmikroskopische Aufnahme einer Insektenzelle, aus der ein Proteinkristall (pink) herausragt. Bild: Michael Duszenko/Universität Tübingen
Kontakt:
Prof. Dr. Christian Betzel
Universität Hamburg
Laboratorium für Strukturbiologie
von Infektionen und Entzündungen
t. 040.8998-4744
e. Christian.Betzel-at-uni-hamburg.de
Dr. Lars Redecke
Universität zu Lübeck und Universität Hamburg
Laboratorium für Strukturbiologie
von Infektionen und Entzündungen
t. 040.8998-5389
e. Lars.Redecke-at-chemie.uni-hamburg.de
Mit Superlasern die Erreger der Schlafkrankheit entschlüsseln
Mehr über die Proteinstruktur zu wissen, ist besonders wichtig, da nur sie Aufschluss darüber gibt, welche Funktion das Protein bei der Steuerung einer Zelle in Organismen übernimmt. Im Fall eines Krankheitserregers liefert das Wissen über die Struktur z.B. die Grundlage für die Bekämpfung bakterieller Zellen oder Parasiten und unterstützt die Entwicklung neuer Wirkstoffe gegen diese Erreger.
Bisher war zur Aufklärung der dreidimensionalen Struktur von Proteinen ein aufwendiges Verfahren nötig. Wissenschaftlerinnen und Wissenschaftler mussten von ausgewählten Proteinen Kristalle mit einer Kantenlänge von mindestens 100 Mikrometer in jede Richtung züchten, bis sie mit Röntgenstrahlen untersucht werden konnten. Ein Vorgang, der mehrere Wochen oder Monate dauern kann.
Die Lösung: Strahlungsblitze
Jetzt geht es kleiner: Mit Hilfe eines Superröntgenlasers ist es den Strukturbiologen gelungen, auch Kristalle, die nur wenige Mikrometer messen, zu analysieren.
Die Forschergruppe züchtete in einer lebenden Insektenzelle erstmals Nanokristalle des Enzyms Cathepsin B aus dem Parasiten Trypanosoma brucei, dem Erreger der Schlafkrankheit. Diese Kleinstkristalle können nicht mit herkömmlichen Röntgenanalysen untersucht werden, nur mit hochintensiven Röntgenimpulsen.
Im kalifornischen Beschleunigerzentrum SLAC (Stanford Linear Accelerator Center) haben die Forscher den geeigneten Superröntgenlaser gefunden, der im Vergleich zu konventioneller Röntgenstrahlung mit einem mehr als eine Milliarde Mal helleren Strahlungsblitz auf die Kristalle schießt. Das Ergebnis sind Daten zur Proteinstruktur von Nanokristallen in hoher Qualität.
Beschleunigte Analyseergebnisse
„Unser Ergebnis zeigt, dass die Superlaser völlig neue Möglichkeiten in der Strukturaufklärung biologischer Makromoleküle bieten können“, sagt Dr. Lars Redecke, Leiter der Nachwuchsgruppe „Strukturelle Infektionsbiologie unter Anwendung neuartiger Strahlungsquellen (SIAS)“. SIAS forscht seit 2010 zur Anwendung neuartiger Strahlungsquellen auf die Strukturbestimmung von biologischen Molekülen.
„Vielleicht sind die Zeiten bald vorbei, in denen wir oft Monate oder Jahre brauchten, um von bestimmten Proteinen Kristalle zu züchten, die groß genug für Synchrotronstrahlungsquellen sind“, so Redecke. Ab 2015 wird mit dem „Europäischen X-FEL“ beim DESY ein Superlaser in Betrieb gehen, dann werden die Untersuchungen direkt in Hamburg geschehen können.
Neben der vom Bundesministerium für Bildung und Forschung geförderten Nachwuchsgruppe SIAS der Universitäten Hamburg und Lübeck und der Hamburg School for Structure and Dynamics in Infection (SDI) der Landesexzellenzinitiative Hamburg, waren der Hamburger Strukturforscher Prof. Christian Betzel, ein Forscherteam um Prof. Michael Duszenko von der Universität Tübingen und Prof. Henry Chapman vom DESY beteiligt.
Originalveröffentlichung
"In vivo protein crystallization opens new routes in structural biology"; Michael Duszenko et al.; "Nature Methods", Advance Online Publication; DOI: 10.1038/nmeth.1859
Bisher war zur Aufklärung der dreidimensionalen Struktur von Proteinen ein aufwendiges Verfahren nötig. Wissenschaftlerinnen und Wissenschaftler mussten von ausgewählten Proteinen Kristalle mit einer Kantenlänge von mindestens 100 Mikrometer in jede Richtung züchten, bis sie mit Röntgenstrahlen untersucht werden konnten. Ein Vorgang, der mehrere Wochen oder Monate dauern kann.
Die Lösung: Strahlungsblitze
Jetzt geht es kleiner: Mit Hilfe eines Superröntgenlasers ist es den Strukturbiologen gelungen, auch Kristalle, die nur wenige Mikrometer messen, zu analysieren.
Die Forschergruppe züchtete in einer lebenden Insektenzelle erstmals Nanokristalle des Enzyms Cathepsin B aus dem Parasiten Trypanosoma brucei, dem Erreger der Schlafkrankheit. Diese Kleinstkristalle können nicht mit herkömmlichen Röntgenanalysen untersucht werden, nur mit hochintensiven Röntgenimpulsen.
Im kalifornischen Beschleunigerzentrum SLAC (Stanford Linear Accelerator Center) haben die Forscher den geeigneten Superröntgenlaser gefunden, der im Vergleich zu konventioneller Röntgenstrahlung mit einem mehr als eine Milliarde Mal helleren Strahlungsblitz auf die Kristalle schießt. Das Ergebnis sind Daten zur Proteinstruktur von Nanokristallen in hoher Qualität.
Beschleunigte Analyseergebnisse
„Unser Ergebnis zeigt, dass die Superlaser völlig neue Möglichkeiten in der Strukturaufklärung biologischer Makromoleküle bieten können“, sagt Dr. Lars Redecke, Leiter der Nachwuchsgruppe „Strukturelle Infektionsbiologie unter Anwendung neuartiger Strahlungsquellen (SIAS)“. SIAS forscht seit 2010 zur Anwendung neuartiger Strahlungsquellen auf die Strukturbestimmung von biologischen Molekülen.
„Vielleicht sind die Zeiten bald vorbei, in denen wir oft Monate oder Jahre brauchten, um von bestimmten Proteinen Kristalle zu züchten, die groß genug für Synchrotronstrahlungsquellen sind“, so Redecke. Ab 2015 wird mit dem „Europäischen X-FEL“ beim DESY ein Superlaser in Betrieb gehen, dann werden die Untersuchungen direkt in Hamburg geschehen können.
Neben der vom Bundesministerium für Bildung und Forschung geförderten Nachwuchsgruppe SIAS der Universitäten Hamburg und Lübeck und der Hamburg School for Structure and Dynamics in Infection (SDI) der Landesexzellenzinitiative Hamburg, waren der Hamburger Strukturforscher Prof. Christian Betzel, ein Forscherteam um Prof. Michael Duszenko von der Universität Tübingen und Prof. Henry Chapman vom DESY beteiligt.
Originalveröffentlichung
"In vivo protein crystallization opens new routes in structural biology"; Michael Duszenko et al.; "Nature Methods", Advance Online Publication; DOI: 10.1038/nmeth.1859
A. Bärthel
